Questions aux experts
Matière et matériaux
Mise en évidence des gaz dissous dans l'eau
Ma question porte sur la solubilité des gaz dans l'eau : je désire montrer aux élèves par des expériences que dans une boisson gazeuse, il y a des molécules de gaz dissoutes et que ce gaz n'est pas de l'air. Quelles expériences me conseilleriez-vous pour montrer que ce gaz n'est pas de l'air ? Un manuel, propose de prendre un verre A contenant de l'eau gazeuse et un verre B avec de l'eau du robinet, de placer une bougie allumée dans chaque verre. La bougie du verre B reste allumée et non celle du verre A. J'ai essayé et aucun résultat satisfaisant. Merci de votre aide !
Bonjour,
L'expérience que vous avez essayée ne peut être probante car le peu de gaz qui se dégage de l'eau gazeuse est insuffisant pour isoler la flamme de la bougie de l'air, si c'est l'effet recherché. De plus, la combustion de la bougie produit, elle aussi, du gaz carbonique (dioxyde de carbone. On ne peut donc rien conclure. Mais votre question est double : en effet, vous dites vouloir montrer la solubilité des gaz et, d'autre part, montrer que le gaz des boissons gazeuses n'est pas de l'air. Montrer la solubilité me semble hors de propos à l'école primaire, sinon en faisant observer qu'au début du chauffage de l'eau des petites bulles se forment au fond du récipient, c'est l'air dissous qui s'échappe, ou encore que les poissons respirent dans l'eau grâce à l'air qui y est dissous. Parler de molécules est aussi hors programme. En ce qui concerne la nature du gaz des boissons, il est nécessaire de disposer d'eau de chaux, liquide qui se trouble (devient blanc) en présence de gaz carbonique. Si vous versez un peu d'eau de chaux dans de l'eau douce, aucun trouble n'apparaît, dans de l'eau gazeuse le liquide devient blanc laiteux. Ce qui est intéressant, c'est aussi de souffler dans de l'eau de chaux. Elle se trouble car nous rejetons un air chargé de gaz carbonique (voir ce qui concerne la respiration).






Recueillir le maximum de gaz dans un flacon est la première opération pour pouvoir étudier les propriétés du gaz qui se dégage d'une eau gazeuse. Le dispositif suivant est efficace car seul le gaz s'échappe.
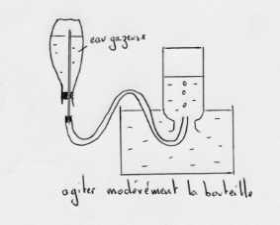
L'expérience qui consiste à introduire une bougie retenue par un fil de fer dans le flacon contenant le gaz recueilli et un autre contenant de l'air est une variante qui permet des observations satisfaisantes. Il faut noter qu'une bougie introduite dans un flacon qui contient, en partie égales, du gaz carbonique et de l'air s'éteint dès que la flamme atteint l'ouverture du flacon. Il suffit donc d'une certaine proportion de gaz carbonique dans l'air pour éteindre une bougie.
Une autre situation donne des résultats satisfaisants. Elle utilise le fait que le gaz carbonique est plus lourd que l'air. Quand on renverse un flacon plein de gaz carbonique sur un flacon plein d'air où se trouve une bougie allumée, la flamme s'éteint.
Ainsi on transvase le gaz carbonique comme un liquide : c'est parce qu'il est plus lourd que l'air. En effet, la masse d'un litre d'air est d'environ 1,3 g, alors que celle d'un litre de gaz carbonique est d'environ 2 g. Il faut noter que dans l'air, un gaz plus lourd que l'air tend à descendre, un gaz plus léger tend à s'élever, mais deux gaz inégalement pesants (air et gaz carbonique) mis dans un même flacon, se mélangent et occupent l'un et l'autre tout le flacon et d'une façon générale tendent à se répandre dans tout l'espace environnant (expansibilité des gaz).